| ■■研究内容の紹介■■ 生体関連物質化学研究領域 |
| ■生体関連物質化学研究者■ 青山 安宏→ 石森 浩一郎→ 今中 忠行→ 江崎 信芳→ 杉浦 幸雄→ 三木 邦夫→ |
私達の研究室では、細胞内で起こっている様々な現象を化学的に捉え、生命システムの解明とともに革新的な医療技術の確立を目指した研究に取り組んでいます。具体的には以下のような研究を行っています。 1)細胞内での効率的な遺伝子検出法を確立し、これをウイルスやバクテリアの簡便な検出に応用する。 2)細胞内でタンパク質が合成される仕組みを明らかにし、これを配列が制御された新規高分子合成に応用する。 3)細胞内に効率よく遺伝子を導入する技術を確立し、遺伝子治療に新機軸をうちたてる。 4)細胞内での遺伝子の発現を制御する技術を確立し、医薬面で応用する。 5)細胞内での情報伝達の仕組みを解明し、これを新薬の合成に応用する。 ↑このページの先頭へ ヒトゲノムの解読が終わって、次はその遺伝子がコードしている蛋白質の時代といわれています。蛋白質は、私たちの体内で生命維持に必要ないろいろな反応の主役を演じていますが、その実態については、まだまだわからないことが数多く残されているのが現状です。私たちの研究グループでは、化学、物理、生物の知識を駆使して蛋白質の構造と機能を明らかにすることで、生命活動をミクロの目で解明し、さらに、進んで蛋白質の構造や機能の人工的な設計を試みることを通して、新規薬剤の開発や高機能な触媒などの実現を目指して研究を行なっています。代表的な研究テーマには以下の通りです。 (1) 金属蛋白質の構造と機能の解明:金属イオンは蛋白質に取り込まれることにより、蛋白質により多彩な機能を付け加えています。実際に呼吸や薬物代謝、恒常性維持など生命活動に重要な多くの反応において、金属蛋白質の活躍の場は無数にあります。このような金属蛋白質を物理化学的な手法で検討することで、その分子機構の解明を試みています。 (2) 蛋白質の立体構造形成過程の分子機構:蛋白質が1本のポリペプチド鎖からどのようにして一定の立体構造を形成してその機能を発揮するのか、そのメカニズムについて、種々のユニークな方法論で追求しています。 (3) 新規金属蛋白質の分子設計:金属蛋白質の構造や機能を自由に設計するために、どのような設計法が蛋白質には有効なのかを考え、天然の蛋白質や酵素では実現できない反応性や物性を示す人工金属蛋白質の実現を目指しています。 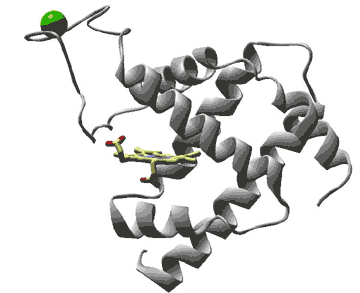 金属イオンによって酸素分子の結合能力が制御できる人工金属蛋白質のモデル図: 図左上の球が金属イオン、酸素分子は図中央左のヘム(鉄イオンを含む錯体)に結合する。 ↑このページの先頭へ 近年になって、これまで無菌状態であると考えられてきた火山付近の熱水環境、深海の高圧環境、深い地下環境などの「極限環境」にも、個々の環境に見事に適応した「極限環境微生物」が多数生息していることが明らかとなってきています。極限環境微生物が生育する環境は原始地球と類似していることから、これらは微生物における「生きた化石」であり、始原的生命の特徴を数多く有していると考えられています。また極限環境微生物が産生するタンパクは耐熱性が優れているなど、これまでにない優れた特徴をもつことが判明しており、産業応用の観点からも注目を集めています。 私たちの研究グループでは、極限環境微生物が有する生命維持戦略についてゲノム情報や生化学・分子生物学的手法を用いて、包括的な研究を行っています。これらの結果をもとに、新たな観点から生命進化に関する考察を行うと同時に、二酸化炭素の固定や水素を作り出す微生物の育種などによる地球環境の改善に取り組んでいます。  ↑このページの先頭へ ■ 江崎 信芳(化学研究所 環境物質化学研究系IV 分子微生物化学研究領域) 私たちの研究グループは、生体内で必須の役割を担っている有機カルコゲン分子や金属カルコゲンクラスターを対象とし、その合成機構、特にこれらを特徴づける硫黄・セレニウムの導入機構の詳細を明らかにする研究を行っています。代表的な研究テーマには次のようなものがあります。 (1)鉄硫黄クラスター形成機構の解明:生物は鉄硫黄クラスターなしでは生きていけません。その鉄硫黄クラスターは生体内において自発的に形成されるものではなく、様々なタンパク質の関与によって形成されるのですが、その生合成機構には、まだまだわかっていないことが多く残されています。そこで鉄硫黄クラスターの生合成機構を詳細に明らかにします。 (2)修飾tRNA形成機構の解明:タンパク質を合成する際、タンパク質を形成する各アミノ酸に対応するtRNAが必要となります。そのtRNAのいくつかは、硫黄やセレニウムで修飾されていることがわかっていますが、その詳細な生合成機構はわかっていません。そこで修飾tRNAの詳細な形成機構を明らかにします。 (3)セレニウム導入の分子機構解明:セレニウムは生体にとって必須の元素ですが、毒性も持ち合わせています。ある種の酵素はその活性発現にセレノシステイン残基が必要となります。そこで、生体内におけるセレニウムの動態も含め、生体分子へのセレニウム導入の分子機構を明らかにします。 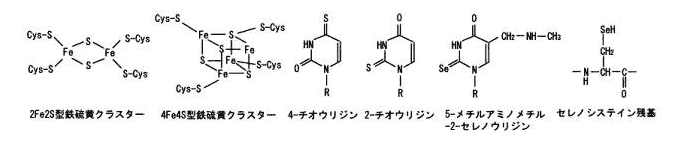 ↑このページの先頭へ DNAに結合するタンパク質は、幾つかのモチーフをもっています。亜鉛フィンガーモチーフは2つのシステインと2つのヒスチジンが亜鉛に四面体に配位し、特定の折りたたまれたタンパク質構造を形成しています。この構造によってDNA配列を読み取ります。亜鉛がないとタンパク質はDNAを読み取ることが出来ません。ヒトゲノム解析から、その全遺伝子の約3%は亜鉛フィンガータンパク質です。マルチ亜鉛フィンガーの生物学的意義、何故生物は亜鉛を使っているのか、新しい亜鉛フィンガータンパク質の創出など、遺伝子に指令を与える亜鉛フィンガータンパク質の構造と機能、さらには医薬化学的応用について研究しています。 ↑このページの先頭へ 私たちのからだの中で起こっている生物が生命を維持するために必要なすべての化学反応は,触媒として働いている非常に多くのタンパク質が互いに協力することによって担われています.タンパク質は20種類のアミノ酸が鎖のようにつながった高分子(ポリマー)ですが,実際に私たちのからだの中で働くときには,その鎖が折れたたまれて球状の状態になります(立体構造を形成する,といいます).どのように折れたたまれているかということが,非常に多くの生体内化学反応を極めて巧みに制御することに密接に関係しています.したがって,タンパク質分子の立体構造を知ることは,それぞれのタンパク質の働き,すなわち,生命現象をしくみを理解する上で必要不可欠なことです.私たちの研究グループは,タンパク質の立体構造を決定して,それぞれのタンパク質がつかさどる生命反応の分子メカニズムを研究しています.そのために,タンパク質の結晶(図左)をつくり,それにシンクロトロン放射光で得られる大きな強度のX線を利用して,その立体構造を実験的に決定しています.得られる立体構造(図右)から,生命現象のさまざまなメカニズムを理解することができます. 図・タンパク質の結晶(左)とその立体構造(右) 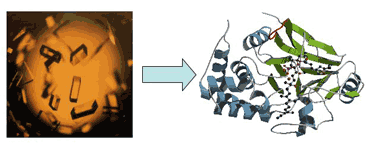 ↑このページの先頭へ |
| 前のページに戻る |